Enzimas, catalizadores biológicos
Las enzimas son proteínas que catalizan
reacciones químicas en los seres vivos. Las enzimas son catalizadores, es
decir, sustancias que, sin consumirse en una reacción, aumentan notablemente su
velocidad. No hacen factibles las reacciones imposibles, sino que solamente
aceleran las que espontáneamente podrían producirse. Ello hace posible que en
condiciones fisiológicas tengan lugar reacciones que sin catalizador
requerirían condiciones extremas de presión, temperatura o pH.
La
sustancia sobre la cual actúa una enzima se llama sustrato.
Los
sustratos son específicos para cada enzima:
Ej:
La sacarosa es el sustrato de la sacarasa que actúa
rompiéndola en sus componentes.
Las enzimas actúan de acuerdo con la siguiente
secuencia: La enzima (E) y el sustrato
(S) se
combinan para formar un complejo intermedio enzima sustrato (E-S), el cual se descompone formando un
producto y regenerando la enzima.
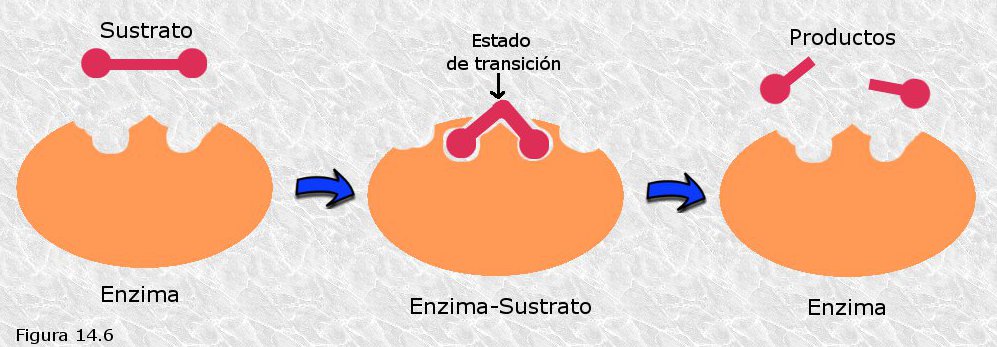
Modelo de la “llave-cerradura”
Las
enzimas son muy específicas, como sugirió Emil Fischer en 1894. Con base a sus
resultados dedujo que ambas moléculas, la enzima y sus sustrato, poseen
complementariedad geométrica, es decir, sus estructuras encajan exactamente una
en la otra, por lo que este modelo ha sido denominado como modelo de la “llave-cerradura”,
refiriéndose a la enzima como a una especie de cerradura y al estado de
transición como una llave que encajan entre las dos.
Cinética enzimática
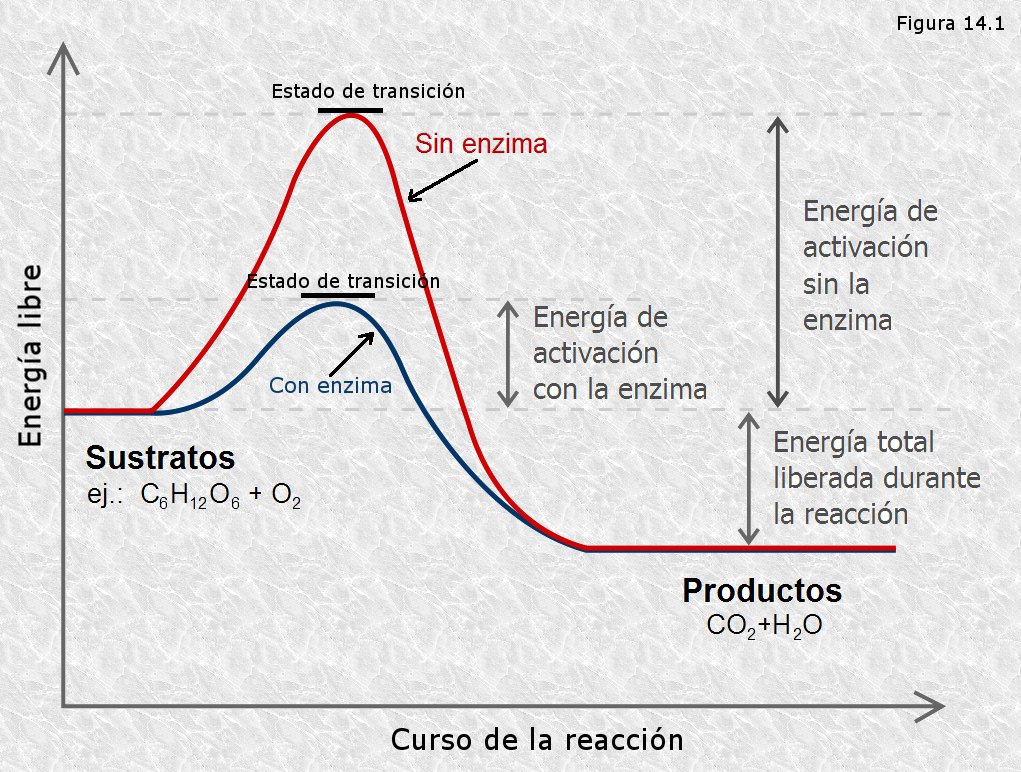
Virtualmente todas las reacciones químicas tienen una barrera energética que separa a los reactivos, reactantes o substratos de los productos. Esta barrera se denomina energía libre de activación que es la diferencia en energía que existe entre los reactivos y los productos. El lugar donde la energía libre de activación es máxima, se denomina estado de transición.
Cinética Michaelis-Menten
Michaelis y Menten propusieron un modelo simple para explicar la mayoría de las reacciones catalizadas por enzimas. En este modelo la enzima se combina reversiblemente con su substrato para formar el complejo enzima-sustrato (ES) que subsecuentemente se rompe para formar el producto, hecho que regenera a la enzima.
Las ecuaciones usadas en este modelo son:
Explicación de esta cinética
Cofactores enzimáticos
Existen enzimas simples que
son aquellas que constan solo de una estructura proteica. Pueden estar formadas
por una o varias cadenas polipeptídicas.
Cinética Michaelis-Menten
Michaelis y Menten propusieron un modelo simple para explicar la mayoría de las reacciones catalizadas por enzimas. En este modelo la enzima se combina reversiblemente con su substrato para formar el complejo enzima-sustrato (ES) que subsecuentemente se rompe para formar el producto, hecho que regenera a la enzima.
Las ecuaciones usadas en este modelo son:
Explicación de esta cinética
Cofactores enzimáticos
Existen enzimas simples que
son aquellas que constan solo de una estructura proteica. Pueden estar formadas
por una o varias cadenas polipeptídicas.
Enzimas conjugadas también se les
llama holoenzimas, poseen en su estructura una parte no proteica
denominada cofactor y una parte proteica que se denomina apoenzima. Para
que estas enzimas actúen como catalizadores es necesario que la apoenzima se
une al cofactor. El
término cofactor puede aplicarse tanto a un ion como a una molécula orgánica de
naturaleza variable. Las coenzimas se unen no
covalentemente a la apoenzima permitiendo que la holoenzima así formada lleve a
cabo reacciones que la apoenzima sola no puede efectuar.
Coenzimas y vitaminas
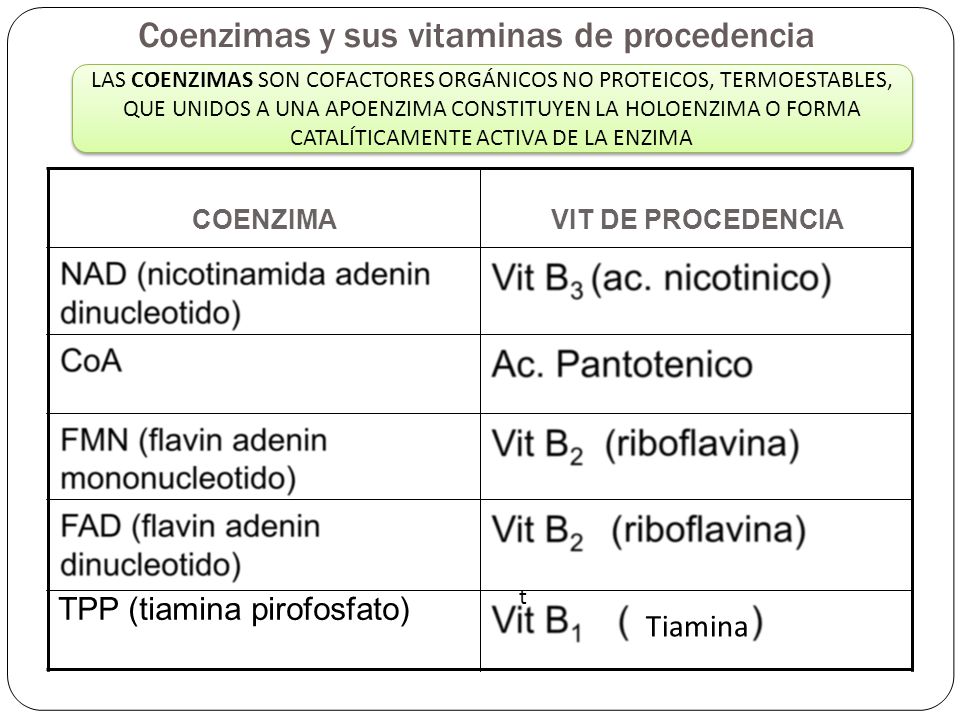
La evolución ha producido un conjunto espectacular de proteínas
catalizadoras, pero el repertorio catalítico de un organismo no se limita por
la reactividad de grupos suministrados por los residuos de aminoácido en las
enzimas. Hay otras especies químicas, llamadas cofactores, que participan con frecuencia
en la catálisis. Las apoenzimas (sólo proteínas) inactivas requieren de los cofactores para convertirse
en holoenzimas activas. Hay dos tipos de cofactores: los iones esenciales (principalmente iones
metálicos) y los compuestos orgánicos llamados coenzimas. Los
cofactores, tanto inorgánicos como orgánicos, se transforman en partes
esenciales de los sitios activos de ciertas enzimas.
Muchos de los minerales que necesitan todos los organismos son
esenciales porque son cofactores. Algunos iones esenciales, llamados iones
activadores, están unidos en forma reversible, y con frecuencia participan en
el enlazamiento de los sustratos. En contraste, algunos cationes están
fuertemente unidos, y a menudo participan en forma directa en reacciones
catalíticas.
Más de la cuarta parte de todas las enzimas conocidas requieren
cationes metálicos para tener actividad catalítica total. Estas enzimas se
pueden dividir en dos grupos: enzimas activadas por metal y metaloenzimas. Las enzimas activadas por metal tienen
necesidad absoluta de iones metálicos adicionales, o son estimuladas por
adición de iones metálicos.
Algunas de esas enzimas requieren cationes monovalentes, como y
otras necesitan cationes divalentes, como o Por ejemplo, las cinasas requieren
iones magnesio para el complejo magnesio-ATP que usan como el sustrato donador
de grupo fosforilo.
El magnesio protege a los grupos fosfato, con carga negativa, del
ATP, y los hace más susceptible al ataque nucleofílico. Las metaloenzimas contienen iones metálicos
firmemente unidos en sus sitios activos. Los iones que más se suelen encontrar en
las metaloenzimas son de metales de transición como hierro y zinc, y con menos
frecuencia cobre y cobalto.
Los iones metálicos que se unen fuertemente a las enzimas con
frecuencia tienen funciones predominantes en la catálisis. Los iones de algunas
metaloenzimas pueden funcionar como catalizadores electrofílicos. Al atraer
electrones, los iones metálicos pueden polarizar los enlaces. Por ejemplo, el
cofactor de la enzima anhidrasa carbónica es un átomo electrofílico de zinc
unido a las cadenas laterales de tres residuos de histidina y a una molécula de
agua. La unión con hace que el agua se ionice con más facilidad. Un grupo
carboxilato básico de la enzima elimina a un protón de la molécula de agua
enlazada y produce un ion hidróxido nucleofílico, que ataca al sustrato. Esta enzima tiene una velocidad catalítica muy alta, en parte debido a la
simplicidad de su mecanismo. Muchas otras metaloenzimas de zinc activan a las
moléculas enlazadas de agua de esta manera. Los iones de otras metaloenzimas
pueden tener reacciones reversibles de oxidación y reducción, al transferir
electrones de un sustrato reducido a un sustrato oxidado.






No hay comentarios:
Publicar un comentario