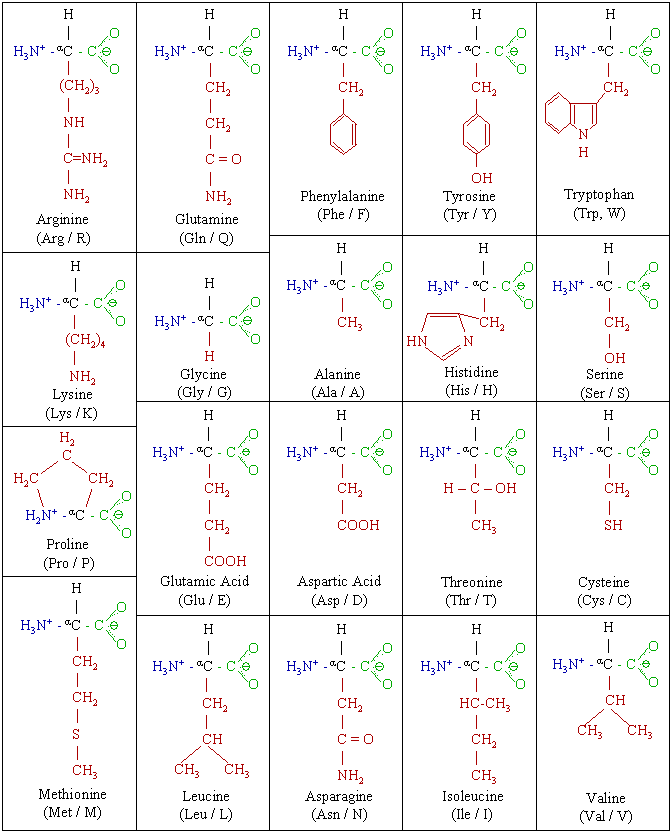
Proteínas
Las proteínas son moléculas formadas por
aminoácidos que están unidos por un tipo de enlaces conocidos como enlaces
peptídicos. El orden y la disposición de los aminoácidos dependen del código
genético de cada persona. Todas las proteínas están compuestas por carbono,
hidrógeno, oxígeno y nitrógeno, y la mayoría contiene además azufre y fósforo.
Las proteínas suponen aproximadamente la
mitad del peso de los tejidos del organismo, y están presentes en todas las
células del cuerpo, además de participar en prácticamente todos los procesos
biológicos que se producen.

Clasificación de las proteínas
Las proteínas son susceptibles de ser clasificadas en función de su
forma y en función de su composición química. Según su forma, existen proteínas
fibrosas (alargadas, e insolubles en agua, como la queratina, el colágeno y la
fibrina), globulares (de forma esférica y compacta, y solubles en agua. Este es
el caso de la mayoría de enzimas y anticuerpos, así como de ciertas hormonas),
y mixtas, con una parte fibrilar y otra parte globular.
Dependiendo de la composición química que posean hay proteínas
simples y proteínas conjugadas, también conocidas como heteroproteínas. Las
simples se dividen a su vez en escleroproteínas y esferoproteínas.
Estructuras de las proteínas
- La estructura
primaria de una proteína es simplemente el
orden de sus aminoácidos. Por convención el orden de escritura es siempre desde
el grupo amino-terminal hasta el carboxilo final.
 La estructura secundaria de
organización de las proteínas incluye a las siguientes estructuras:Alfa-hélice, Beta-lamina o estructura en hoja beta
plegada Paralela, Antiparalela, Giros, beta, vueltas Beta o vueltas
inversas.
La estructura secundaria de
organización de las proteínas incluye a las siguientes estructuras:Alfa-hélice, Beta-lamina o estructura en hoja beta
plegada Paralela, Antiparalela, Giros, beta, vueltas Beta o vueltas
inversas.
Estructura secundaria no repetitiva
Alfa hélice: es el segundo nivel de organización proteica en el
cual el esqueleto peptídico esta enrollado, como una estructura en
espiral, alrededor de un eje imaginario (organización
helicoidal de la cadena peptídica).
Beta
lámina: Esta estructura
secundaria se define como el nivel secundario de organización de las proteínas
en el cual el esqueleto de la cadena peptídica (Beta hebras) se extiende en un
arreglo en zigzag similar a una serie de pliegues, con los enlaces
peptídicos organizados en planos de inclinación alterna (alternando planos
descendentes y planos ascendentes). La
hola plegada beta puede formarse entre dos cadenas peptídicas o entre
diferentes segmentos de una misma cadena peptídica.
a) Alfa hélice b) Beta Lámina
- Se llama estructura terciaria a la disposición tridimensional de todos los átomos que componen la proteína. Esta estructura es la responsable directa de las propiedades biológicas de una proteína, ya que la disposición espacial de los distintos grupos funcionales determina su interacción con los diversos enlaces que se forman.Para las proteínas que constan de una sola cadena polipeptídica, la estructura terciaria es la máxima información estructural que se puede obtener. La estructura terciaria es una disposición precisa y única en el espacio, y surge a medida que se sintetiza la proteína. En otras palabras, la estructura terciaria está determinada por la secuencia de Aminoácidos (provenientes de una estructura primaria).

- La estructura cuaternaria, muchas proteínas consisten de una sola cadena polipeptídica, debido a esto se les denomina proteínas monoméricas o simplemente monómeros. Muchas otras proteínas están formadas por dos o más cadenas polipeptídicas que pueden ser iguales o diferentes, cada una de estas cadenas pueden plegarse antes, durante e incluso después de su asociación para formar el oligómero. Después de la asociación u oligomerización, de los monómeros se obtiene la estructura cuaternaria de la proteína en cuestión. Si en la proteína solo existen dos subunidades, entonces se denomina dímero y puede ser homodímero o heterodímero, dependiendo de si las cadenas de los monómeros son iguales o diferentes, en general también pueden denominarse proteínas multiméricas.

%20II.jpg)