Carbohidratos
Los carbohidratos,
también llamados glúcidos, carbohidratos, hidratos de carbono o sacáridos, son
elementos principales en la alimentación, que se encuentran principalmente en
azúcares, almidones y fibra. La función principal de los carbohidratos es
el aporte energético. Son una de las sustancias principales que necesita
nuestro organismo, junto a las grasas y las proteínas.
Clasificación de los carbohidratos
Ciclación de aldosas y cetosas
El carbono carbonílico de una aldosa que
contenga al menos cinco átomos de carbono, o de una cetosa que contenga al
menos seis átomos de carbono, puede reaccionar con un grupo hidroxilo intramolecular
y formar un hemiacetal cíclico o un hemicetal cíclico, respectivamente. El
átomo de oxígeno del grupo hidroxilo reaccionante se convierte en miembro de
las estructuras anulares con cinco o seis miembros.
Al anillo con seis miembros de un
monosacárido se le llama piranosa. De igual modo, como el anillo con cinco
miembros de un monosacárido se parece al del furano se le llama furanosa. Sin embargo, a diferencia del pirano y del furano, los anillos de
los carbohidratos no contienen dobles enlaces.
El carbono más oxidado de un monosacárido
ciclado, el que está unido a dos átomos de oxígeno, se llama carbono anomérico. En las estructuras de anillo, el carbono anomérico
es quiral. Así, la aldosa o cetosa ciclada puede adoptar cualquiera de dos configuraciones
(designadas a o b). A los isómeros a y b se les
llama anómeros.
En solución, las aldosas y las cetosas que
forman estructuras anulares están en equilibrio entre sus diversas formas
cíclicas y de cadena abierta.
La abundancia relativa de las diversas formas
de monosacárido en el equilibrio refleja las estabilidades relativas de cada
forma. Aunque la D-ribosa no sustituida es más estable en la
forma de b-piranosa, su estructura en los nucleótidos tiene
la forma de b-furanosa.
Ciclación de la fructosa y ribosa
- Proyecciones de Haworth
- Proyecciones de Fischer
 Es posible asignar las designaciones estereoquímicas R,S a las proyecciones de Fischer siguiendo estos tres pasos: Debido a que los carbohidratos son quirales y tienen varios centros de quiralidad, desde hace mucho tiempo se reconoció que es necesario un método estándar de representación para describir la estereoquímica de los carbohidratos. En 1891, Emil Fischer sugirió un método basado en la proyección de un átomo de carbono tetraédrico en una superficie plana. Estas proyecciones de Fischer se adoptaron pronto y ahora representan medios normales de representar la estereoquímica de los centros de quiralidad sobre una página plana, sobre todo en la química de carbohidratos. Un átomo de carbono tetraédrico se representa en una proyección de Fischer con dos líneas cruzadas. Las líneas horizontales representan los enlaces que están hacia delante de la página, y las líneas verticales, los enlaces que están hacia atrás de la misma.
Es posible asignar las designaciones estereoquímicas R,S a las proyecciones de Fischer siguiendo estos tres pasos: Debido a que los carbohidratos son quirales y tienen varios centros de quiralidad, desde hace mucho tiempo se reconoció que es necesario un método estándar de representación para describir la estereoquímica de los carbohidratos. En 1891, Emil Fischer sugirió un método basado en la proyección de un átomo de carbono tetraédrico en una superficie plana. Estas proyecciones de Fischer se adoptaron pronto y ahora representan medios normales de representar la estereoquímica de los centros de quiralidad sobre una página plana, sobre todo en la química de carbohidratos. Un átomo de carbono tetraédrico se representa en una proyección de Fischer con dos líneas cruzadas. Las líneas horizontales representan los enlaces que están hacia delante de la página, y las líneas verticales, los enlaces que están hacia atrás de la misma.
Proyección de Fischer de la L-Ribosa
Derivados
de los monosacáridos
Hay muchos derivados de los monosacáridos
básicos que ya se describieron en las secciones anteriores. Entre estos
derivados están los monosacáridos polimerizados, como los oligosacáridos y los
polisacáridos, igual que varias clases de compuestos no polimerizados.
En esta sección se presentarán algunos derivados
de monosacárido, incluyendo fosfatos de azúcar, desoxi y aminoazúcares,
azúcares alcoholes, azúcares ácidos y el ácido ascórbico (vitamina C).
Igual que otras biomoléculas formadoras de
polímeros, los monosacáridos y sus derivados tienen abreviaturas con las que se
describen los polisacáridos más complejos.
Las abreviaturas aceptadas tienen tres
letras, y en algunos casos se les añaden sufijos.
Los monosacáridos, en las vías metabólicas,
con frecuencia se convierten en ésteres de fosfato
Los fosfatos de triosa, el 5-fosfato de
ribosa y el 6-fosfato de glucosa son ésteres alcohol-fosfato simples.
El 1-fosfato de glucosa es un fosfato de
hemiacetal, más reactivo que un fosfato de alcohol. La capacidad de la
UDP-glucosa para funcionar como donador de glucosilo es una prueba de esta
reactividad.
v
Desoxiazúcares
En esos derivados, un átomo de hidrógeno
sustituye a uno de los grupos hidroxilo del monosacárido
precursor. La 2-desoxi-D-ribosa
es un bloque constructivo importante en el ADN. La L-fucosa
(6-desoxi-L-galactosa) está muy distribuida en plantas,
animales y microorganismos. A pesar de su rara configuración L,
la fucosa se deriva metabólicamente de la D-manosa.
v
Aminoazúcares
v
Azúcares
alcoholes
En un azúcar alcohol el oxígeno carbonílico
del monosacárido precursor se ha reducido y se produce un polihidroxialcohol. La
glicerina y el mio-inositol son componentes importantes de los
lípidos.
v
Azúcares
ácidos
Los azúcares ácidos son ácidos carboxílicos
derivados de las aldosas, sea por oxidación de C-1 (el carbono aldehídico) para
formar un ácido aldónico, o por oxidación del carbono con número mayor (el que
tiene el alcohol primario) para formar un ácido aldurónico. Los ácidos aldónicos existen en la forma de cadena abierta, en
solución alcalina, y forman lactonas (ésteres intramoleculares) al acidularlos.
Los ácidos aldónicos pueden estar como piranosas, por lo que poseen un carbono
anomérico. El ácido N-acetilneuramínico (figura 8.15) es un ácido
aldónico y a la vez un aminoazúcar. Los azúcares ácidos son componentes
importantes de muchos polisacáridos.
Epímero
Cuando dos azúcares
difieren sólo en la configuración de uno de sus átomos de carbono se dice que
son azúcares epímeras. Los epímeros son, pués, diasterómeros. Por ejemplo
D-Glucosa y D-Manosa son epímeras con respecto al carbono 2, mientras que
D-Glucosa y D-Galactosa lo son con
respecto al carbono 4:
Los azúcares en disolución se encuentran mayoritariamente en forma cíclica, llamada hemiacetal. El hemiacetal se obtiene por ataque de uno de los grupos hidroxilo de la cadena sobre el carbonilo. Los ciclos formados son de cinco o seis miembros.
Polisacáridos
Con
frecuencia se divide a los polisacáridos en dos clases extensas. Los homoglicanos
(u homopolisacáridos) son polímeros que sólo
contienen residuos de un tipo de monosacárido. Los
heteroglicanos (o heteropolisacáridos) son
polímeros que contienen residuos
de más de un tipo de monosacárido. A diferencia de las proteínas, cuyas
estructuras primarias se
codifican por el genoma y tienen así longitudes específicas, los
polisacáridos se forman sin una plantilla,
por adición de determinados residuos de monosacárido
y oligosacárido. El resultado es que las
longitudes y las composiciones de las
moléculas de polisacárido pueden variar dentro de una población.
La
mayor parte de los polisacáridos también se pueden clasificar de acuerdo con
sus funciones biológicas. Por ejemplo, el
almidón y el glucógeno son polisacáridos de almacenamiento,
y la celulosa y la quitina son polisacáridos estructurales.
A.
Almidón y glucógeno
Todas
las especies sintetizan D-glucosa. El exceso de glucosa se puede descomponer y producir
energía metabólica. Los residuos de glucosa se almacenan como polisacáridos, hasta
que se necesitan para producir energía. El homoglicano de almacenamiento más
común de la glucosa en las plantas y los hongos es el almidón; y en los
animales es el glucógeno. Ambos tipos de polisacárido existen en las bacterias.
En
las células vegetales, el almidón existe como mezcla de amilosa y amilopectina,
y se almacena en granos cuyos diámetros van de 3 a 100 mm.
La amilosa es un polímero no ramificado de unos 100 a 1 000 residuos de D-glucosa
unidos por enlaces glicosídicos a-(1
→
4), que se llaman específicamente enlaces glicosídicos a-(1
→
4), porque los carbonos anoméricos pertenecen a residuos de
glucosa (figura 8.22a). El mismo tipo de unión conecta los monómeros de glucosa
en el disacárido maltosa. Aunque no es verdaderamente soluble en agua, la
amilosa forma micelas hidratadas en el agua, y puede adoptar una estructura
helicoidal bajo ciertas condiciones (figura 8.22b).
La
amilopectina es una versión ramificada de la amilosa (figura 8.23). Las ramas,
o cadenas laterales poliméricas, están unidas mediante enlaces glicosídicos a-(1
→
6) a las cadenas lineales de residuos, unidos por enlaces glicosídicos
a-(1 → 4).
La ramificación.
Se presenta, en promedio, cada 25 residuos, y
las cadenas laterales contienen unos 15 a 25 residuos de glucosa. Algunas de
las mismas cadenas laterales están ramificadas. Las moléculas de amilopectina
obtenidas de células vivas pueden contener 300 a 6 000 residuos de glucosa.
Un adulto humano consume unos 300 g de carbohidratos
diariamente, gran partede los cuales están en forma de almidón. Los granos
crudos de almidón resisten la hidrólisisenzimática, pero la cocción los hace
absorber agua e hincharse; el almidón hinchado
Es un sustrato de dos glicosidasas. El
almidón en la dieta se degrada en el tracto gastrointestinal por las acciones
de la a-amilasa
y una enzima desramificadora. La a-amilasa, presente en animales y plantas, es
una endoglicosidasa (actúa sobre enlaces glicosídicos.

B. Celulosa y quitina
La celulosa es un polisacárido estructural. Es uno de los principales componentes de las
paredes celulares rígidas que rodean muchas células vegetales. Los tallos y las ramas de
muchas plantas están formados principalmente por celulosa. Este solo polisacárido forma
un porcentaje apreciable de toda la materia orgánica en la Tierra. Igual que la amilosa,
la celulosa es un polímero lineal de residuos de glucosa, pero en la celulosa esos residuos están unidos por enlaces b-(1 → 4) y no por enlaces a-(1 → 4). Los dos residuos
de glucosa del disacárido celobiosa también están unidos por un enlace b-(1 → 4. El tamaño de las moléculas de celulosa varía mucho, y va desde unos 300 hasta más de 15 000 residuos de glucosa.
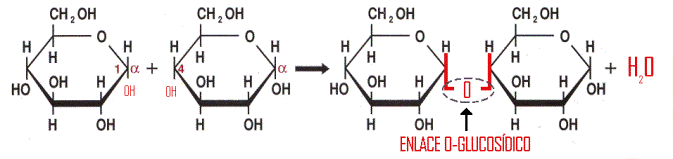
En
el ámbito de los carbohidratos, el enlace glucosídico o glicosídico es el
enlace para unir monosacáridos con el fin de formar disacáridos o
polisacáridos. Su denominación más correcta es enlace O-glucosídico pues se
establece en forma de éter siendo un átomo de oxígeno el que une cada pareja de
unidades de monosacáridos.
Mediante este enlace se unen dos monosacáridos según el siguiente esquema:
Medicamentos con carbohidratos como
principio activo
1.
Condrosan
Ø Nombre comercial: Condrosan
Ø Dosis:
Adultos y ancianos:
No está recomendado para
el uso en niños ni adolescentes
Ø Nombre del carbohidrato: condroitín
sulfato es un glucosaminoglucano formado por:
-
N - acetilgalactosamina.
-
N - ácido
glucurónico.
Ø Estructura:
Ø Características
físico-químicas:
ü El monómero de condroitín sulfato es un
compuesto disacárido de N-Acetilgalactosamina y N-ácido glucurónico. El grupo
sulfato se fija en la galactosamina, en posición 4 y 6, que explica la
existencia de 2 isómeros de condroitín sulfato.
ü Habitualmente se encuentra asociado el
condroitín sulfato a proteínas, constituyendo agregados de alto peso molecular
conocidos como proteoglicanos. Condroitín forma una cadena forjada por más de
100 azúcares individuales, que pueden estar cada uno de ellos sulfatados
en número y posiciones diversas.
ü De longitud variable son las cadenas de
polisacáridos (condroitín sulfato) que contienen 2 monosacáridos alternos:
N-acetil-D-galactosamina (GalNac) y D-ácido glucorónico (GlcA). El
disacárido resultante de los residuos de GlcA que presentan el epímero de ácido
L-idurónico (IdoA) se denomina dermatán sulfato.
ü Las cadenas de glicosaminoglicanos
empiezan la unión con cuatro monosacáridos con patrón fijo: Xyl –Gal – GicA.
Cada enzima específica se une con el azúcar, permitiéndose múltiples niveles de
control sobre la síntesis de gicosaminoglicanos. En el retículo endoplasmático
la xilosa se une a las proteínas, mientras que el resto de los azúcares se unen
al aparato de Golgi.
2. Glucosamina:
Ø Nombre comercial: Glucosamina de 500mg.
Ø Usos: Tratamiento de osteoartritis.
Ø Dosis: Tomar 1 o 2 capsulas tres veces al día, en adultos.
Ø Vía de
administración: Oral.
Ø Almacenamiento: Consérvese en lugar fresco y seco a temperatura entre
15º-30º C (59º-86º F).
Ø Precauciones: Mantenga este producto fuera del alcance de los
niños.
No se administra durante el embarazo o cuando se
sospeche su existencia, ni en periodo de lactancia.
Ø Nombre del
Carbohidrato: Glucosamina.
Ø Formula molecular: (C6H13NO5).
Ø Estructura:
Ø Función: La glucosamina es un amino-azúcar que actúa
especialmente como precursor en la glicosilación de las proteínas y de los
lípidos. La glucosamina se encuentra principalmente en el exoesqueleto de los
artrópodos, en la pared celular de los hongos y en otros muchos organismos,
siendo el monosacárido más abundante. Se sintetiza comercialmente mediante la
hidrólisis de exoesqueletos de crustáceos. La glucosamina también es utilizada
de forma bastante común en el tratamiento de la artritis y la artrosis, a pesar
de que su aceptación como medicamento terapéutico sea variable.
Ø Características
físicas -Masa molar 179.17 g/mol.
-Punto de fusión 423 K (150 °C).
Ø Mecanismo de
acción: Estimula la síntesis de
glicosaminoglicanos y proteoglicanos a través de los condrocitos y de ácido
hialurónico mediante sinoviocitos. Puede inhibir la síntesis de los radicales
superóxido, y la actividad de los enzimas lisosomales, así como la de los enzimas
destructores del cartílago articular tales como la colagenasa y la fosfolipasa
A2.
3.
Dextrosa
Ø Nombre comercial:
DEXTROSE
Ø Estructura:
Ø Dosis:
Los
atletas y culturistas pueden tomar una dosis de 50 gramos
(Entre
0,5 a 0,7 gramos por kilo de peso corporal) inmediatamente después de hacer
ejercicio para optimizar la forma en que el cuerpo procesa las proteínas y
otros nutrientes. Si además incluimos proteínas de rápida absorción junto a la
dextrosa la recuperación se multiplica (1 parte de proteína por dos de
dextrosa). A la vez también deberemos tomar algún carbohidrato con un índice
glucémico más bajo si no se va a consumir ninguna comida en 1 hora después.
Ø Función:
La
dextrosa, también conocida como azúcar de maíz, es un carbohidrato simple. Es
un 70 - 80% tan dulce como la sacarosa (azúcar de mesa) y el cuerpo la absorbe
y utiliza rápidamente proporcionando una fuente de energía rápida.
4.
Artrosamin
Ø Nombre comercial: Artrosamin crema.
Ø Nombre del
carbohidrato: glucosamina.
Estructura:
Ø Usos y dosis:
Es un analgésico de uso externo. Masajear suavemente el área afectada
hasta ver la total desintegración de la crema en su piel. Aplicarse tres veces
al día.
Ø Observaciones: tiempo máximo del tratamiento (si en 8 días
no mejora, se debe suspender su uso y consultar al médico).
La glucosamina se encuentra en sulfato de glucosamina es una sustancia
natural que se encuentra en el cuerpo.
Sirve para tratar osteoartritis de rodillas, sin embargo algunas pruebas
afirman que puede tratar osteoartritis de cadera y columna vertebral.
También para artritis en el área temporomandibular.
Ø Precauciones:
El uso de la glucosamina para tratar la osteoartritis es aparentemente
seguro, pero pude producir efectos colaterales como:
-
Aumento del gas
intestinal.
-
Disposiciones más blandas.



No hay comentarios:
Publicar un comentario